Elektrolitų savybės. Stiprūs ir silpni elektrolitai. Elektrolitai - kas tai?
Puikūs elektros srovės laidininkai - auksas,varis, geležis, aliuminis, lydiniai. Kartu su jais yra didelė grupė nemetalinių medžiagų, lydymosi ir vandeniniai tirpalai taip pat turi laidumo savybes. Tai yra stiprios bazės, rūgštys, kai kurios druskos, bendrai vadinamos elektrolitais. Kas yra joninis laidumas? Leiskite sužinoti, kokį ryšį su elektrolitais turi šis plačiai paplitęs reiškinys.

Kokios dalelės perneša mokesčius?
Visame pasaulyje yra daug įvairių dirigentų, taip patizoliatoriai. Šios kūnų ir medžiagų savybės žinomos nuo seniausių laikų. Graikų matematikas Thalesas atliko gintaro patirtį (graikų kalba - "elektronas"). Matuodamas jį ant šilko, mokslininkas pastebėjo plaukų, vilnonių pluoštų traukos reiškinį. Vėliau tapo žinoma, kad gintaras yra izoliatorius. Šioje medžiagoje nėra dalelių, kurios galėtų būti elektros krūvio. Geri laidai yra metalai. Jų sudėtyje yra atomų, teigiamų jonų ir laisvų, begalybės mažų neigiamų dalelių - elektronų. Jie suteikia mokesčio pervedimą, kai srovė yra perduodama. Stiprūs elektrolitai sausoje formoje neturi laisvų dalelių. Tačiau tirpinant ir tirpstant katalizuoja kristalinė grotelė, taip pat kovalentinės jungties poliarizacija.
Vanduo, neelektrolitai ir elektrolitai. Kas yra tirpimas?
Pateikdami arba prijungdami elektronus, atomusmetaliniai ir nemetaliniai elementai yra paverčiami jonais. Tarp jų kristalų grotelėse yra gana stiprus ryšys. Jono junginių, pavyzdžiui, natrio chlorido, ištirpimas arba tirpimas lemia jo sunaikinimą. Polarinėse molekulėse nėra nei privalomų, nei laisvų jonų, jie susidaro sąveikaujant su vandeniu. XIX a. Devintajame dešimtmetyje M. Faradajas atrado, kad kai kurių medžiagų sprendimai vykdo dabartinius. Moksletas pristatė į mokslą tokias svarbias sąvokas:
- jonai (įkraunamos dalelės);
- elektrolitai (antros rūšies laidininkai);
- katodas;
- anodas.
Yra junginių - stiprių elektrolitų, kurių kristalinės grotelės visiškai suskaidomos su jonų išsiskyrimu.

Yra netirpių medžiagų ir tokių medžiagųyra konservuotos molekulinės formos, pavyzdžiui, cukraus, formaldehido. Tokie junginiai vadinami neelektrolitu. Joms būdingos įkrovimo dalelių susidarymas. Silpni elektrolitai (anglis ir acto rūgštis, amonio hidroksidas ir daugybė kitų medžiagų) turi nedaug jonų.
Elektrolitinės disociacijos teorija
Savo darbuose Švedijos mokslininkas S. Arrhenius (1859-1927) rėmėsi Faradėjos išvadomis. Vėliau jo teorijos nuostatas paaiškino Rusijos mokslininkai I. Kablukovas ir V. Kistiakovskis. Jie sužinojo, kad jonų tirpinimas ir lydymas sudaro ne visas medžiagas, o tik elektrolitus. Kas yra S. Arrhenio disociacija? Tai yra molekulių sunaikinimas, dėl kurio atsiranda įdėta dalelių ir tirpsta. Pagrindinės S. Arrheniaus teorinės nuostatos:
- Pagrindai, rūgštys ir druskos tirpaluose yra atskiestos formos.
- Grįžtamai suskaidyti į jonus stiprūs elektrolitai.
- Silpni jonai sudaro nedaug jonų.

Medžiagos (josdažnai išreiškiamas procentais) yra molekulių, kurios sulūžo į jonus, skaičius ir bendras dalelių kiekis tirpale. Elektrolitai yra stiprūs, jei šio rodiklio vertė yra daugiau nei 30%, o silpniems - mažesni nei 3%.
Elektrolitų savybės
S. teorinės išvados Arrhenius buvo papildytas vėlesniais Rusijos mokslininkų atliekamais fizikinių ir cheminių procesų sprendimais ir tirpimais. Bazių ir rūgščių savybės buvo paaiškintos. Pirmasis apima junginius, kurių tirpaluose iš katijonų gali būti tik metalo jonai, anijonai yra dalelės OH-. Rūgščių molekulės skirstomos į neigiamus rūgščiųjų liekanų jonus ir vandenilio protonus (H+) Jų judėjimas tirpale ir lydyme yra chaotiškas. Apsvarstykite eksperimento rezultatus, už kuriuos turėsite surinkti grandinę, įskaitant anglies elektrodus ir įprastą kaitinamą lemputę. Patikrinkime įvairių medžiagų tirpalų laidumą: paprastąją druską, acto rūgštį ir cukrų (pirmieji du elektrolitai). Kas yra elektros grandinė? Tai yra srovės šaltinis ir laidininkai, sujungti kartu. Kai grandinė uždaryta, lemputė šviečia druskos tirpale. Jonų judėjimas įgauna tvarką. Anijonai nukreipiami į teigiamą elektrodą ir katijonus į neigiamą elektrodą.
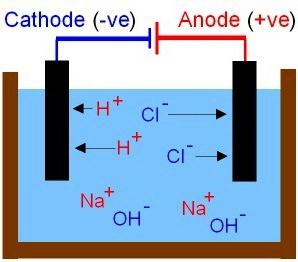
Šiame procese dalyvauja acto rūgštisnedidelis kiekis dalelių. Cukrus nėra elektrolitas, jis nesielgia srovės. Tarp šio tirpalo elektrodų bus izoliacinis sluoksnis, lemputė nebus dega.
Cheminė sąveika tarp elektrolitų
Kai tirpalai nusausinami, galima pastebėti, kaip jie vedasave elektrolitus. Kokios yra panašių reakcijų jonų lygtys? Apsvarstykite, pavyzdžiui, cheminę bario chlorido ir natrio nitrato sąveiką:
2NaNO3 + BaCl2 + = 2NaCl + Ba (NO3)2.
Elektrolitų formules galima parašyti jonine forma:
2Na+ + 2NO3- + Ba2+ + 2 Cl- = 2Na+ + 2 Cl- + Ba2+ + 2NO3-.
Reakcijai naudojamos medžiagos yra stipri elektrolitai. Šiuo atveju jonų sudėtis nesikeičia. Elektrinių tirpalų cheminė sąveika yra įmanoma trimis atvejais:
1. Jei vienas iš produktų yra netirpi medžiaga.
Molekulinė lygtis: Na2Taip4 + BaCl2 = BaSO24 + 2 NaCl.
Leisk mums parašyti jonų formos elektrolitų sudėtį:
2Na+ + SO42- + Ba2+ + 2 Cl- = BaSO24 (baltos nuosėdos) + 2Na+ 2Cl-.
2. Viena iš sudedamųjų medžiagų yra dujos.
3. Tarp reakcijos produktų yra silpnas elektrolitas.

Vanduo yra vienas iš silpniausių elektrolitų
Chemiškai grynas vanduo (distiliuotas) neveikia elektros srovės. Tačiau jo sudėtyje yra nedidelis įkrautų dalelių kiekis. Tai yra protonai H+ ir anijonai OH-. Nedidelis kiekis vandens molekulių yra disociacijos. Yra vertė - vandens jonų produktas, pastovus 25 ° C temperatūroje. Tai leidžia žinoti H koncentracijas+ ir OH-. Rūgščių tirpaluose vyrauja vandenilio jonai, šarmose didesnės hidroksido anijonai. Neutraliame - numeris H+ ir OH-. Tirpalo terpė taip pat būdinga vandenilio indeksui (pH). Kuo didesnis, tuo daugiau hidroksido jonų. Terpė yra neutrali, kai pH intervalas yra artimas 6-7. Esant H jonams+ ir OH- pakeisti spalvų indikatorių medžiagas: lakmusą, fenolftaleiną, metilorangą ir kitus.
Elektrolitų tirpalų ir lydinių savybėsyra plačiai naudojami pramonėje, inžinerijoje, žemės ūkyje ir medicinoje. nustatyta pagal neapmokėtų mokslininkų skaičius Mokslinis pagrindimas paaiškinti dalelių, kurios susideda iš druskos, rūgščių ir bazių elgesį. Savo sprendimuose įvyksta įvairios jonų mainų reakcijos. Jie naudojami daugybėje pramoninių procesų, elektrocheminiuose, elektrolizės. Gyvų būtybių procesai taip pat vyksta tarp jonų tirpaluose. Daug metalai ir nemetalų, toksiški atomų ir molekulių, būtinas elementas dalelės (natrio, kalio, magnio, chloro, fosforo ir kiti) formoje.



