Kas yra anglies monoksidas? Molekulės struktūra
Anglies monoksidas, taip pat žinomas kaip anglies monoksidasdujos, turi labai stiprią molekulinę sudėtį, yra cheminių savybių inertiškumas ir blogai tirpsta vandenyje. Šis junginys taip pat yra neįtikėtinai toksiškas, kai patenka į kvėpavimo sistemą, jis jungiasi su kraujo hemoglobinu ir nustoja perkelti deguonį į audinius ir organus.

Cheminiai pavadinimai ir formulė
Anglies monoksidas taip pat žinomas pagal kitaspavadinimai, įskaitant anglies monoksidą II. Kasdieniniame gyvenime tai paprastai vadinama anglies monoksidu. Šis anglies monoksidas yra toksiškas, bespalvis ir beskonis dujos, kurios bekvapės. Jo cheminė formulė yra CO, o vienos molekulės masė yra 28,01 g / mol.

Poveikis kūnui
Anglies monoksidas sujungiamas su hemoglobinukarboksihemoglobino, kuris neturi deguonies galios, susidarymas. Įkvėpus jos garus, atsiranda centrinės nervų sistemos (CNS) ir uždusimo priežastis. Gautas deguonies trūkumas sukelia galvos skausmą, galvos svaigimą, sumažėjusią pulsą ir kvėpavimo dažnį, dėl ko atsiranda alpulys ir vėliau miršta kūnas.

Toksiška dujos
Anglies monoksidas gaminamas dalinaimedžiagų, kurių sudėtyje yra anglies, deginimas, pavyzdžiui, vidaus degimo varikliuose. Junginyje yra 1 anglies atomas, kovalentiškai susijęs su 1 deguonies atomu. Anglies monoksidas yra labai toksiškas, ir tai yra viena iš labiausiai paplitusių mirties priežasčių apsinuodijimo visame pasaulyje priežasčių. Poveikis gali sukelti žalą širdžiai ir kitiems organams.

Koks yra anglies monoksido naudojimas?
Nepaisant rimto toksiškumo, jis yra monoksidasanglies yra labai naudinga - šiuolaikinės technologijos dėka sukurta daugybė gyvybiškai svarbių produktų. Anglies monoksidas, nors šiandien laikomas teršalu, visada buvo gamtoje, bet ne tokiu kiekiu, kaip, pavyzdžiui, anglies dioksidas.
Tie, kurie tiki, kad jų nėra, yra klaidingigamtinės anglies monoksido junginiai. CO ištirpsta išlydytoje ugnikalnio uoloje esant dideliam slėgiui žemės apvalkale. Anglies oksidų kiekis vulkaninėse dujose, priklausomai nuo ugnikalnio, svyruoja nuo mažiau nei 0,01% iki 2%. Kadangi šio junginio natūrali vertė nėra pastovi, gamtinių dujų išmetimą neįmanoma tiksliai išmatuoti.

Cheminės savybės
Anglies monoksidas (CO formulė) reiškia ne druskos formavimąsi ar indiferentinius oksidus. Tačiau, esant +200 temperatūrai oC reaguoja su natrio hidroksidu. Per šį cheminį procesą susidaro natrio formatas:
NaOH + CO = HCOONa (skruzdžių rūgšties druska).
Anglies monoksido savybės yra pagrįstos jo mažinančiu sugebėjimu. Anglies monoksidas:
- gali reaguoti su deguonimi: 2CO + O2 = 2CO2;
- gali reaguoti su halogenais: CO + Cl2 = COCl2 (fosgenas);
- turi unikalią savybę gryniems metalams iš jų oksidų: Fe2O3 + 3CO = 2Fe + 3CO2;
- formuoja karbonilus iš metalų: Fe + 5CO = Fe (CO)5;
- puikiai tirpsta chloroforme, acto rūgštyje, etanolyje, amonio hidroksidu ir benzenu.

Molekulinė struktūra
Du atitai, iš kurių iš tikrųjų sudaroAnglies monoksido (CO) molekulė yra susijusi trigubu ryšiu. Du iš jų yra suformuota sujungus p-elektronus arba keli iš anglies atomų su deguonimi, o trečiasis - dėka specialiu mechanizmu dėl kainuoja anglies 2p orbitos ir 2p-elektronų porų deguonies. Ši struktūra suteikia didelę molekulę.

Šiek tiek istorijos
Aprašyta Aristotelis iš senovės Graikijosnuodingi dūmai, pagaminti deginant anglį. Pačios mirties mechanizmas nebuvo žinomas. Tačiau vienas iš seniausių bausmės vykdymo būdų buvo užkertamas kelias įstatymo viršenybei garų salėje, kurioje buvo angelai. Graikijos gydytojas Galenas pasiūlė, kad į orą prasiskverbtų tam tikri pokyčiai, kurie gali pakenkti įkvėpus.
Antrojo pasaulinio karo metu dujinis mišinys supriemaišos anglies monoksidas, buvo naudojamas kaip transporto priemonių tose pasaulio, kur buvo ribotas kiekis benzino ir dyzelino dalys kuro. išorės (su kai kuriomis išimtimis) generatoriai anglimi arba medienos dujas buvo nustatyta, bet iš atmosferos azoto, anglies monoksido, ir mažais kiekiais kitų tiekiamų dujų maišytuvu dujų mišinys. Tai buvo vadinamosios medienos dujos.
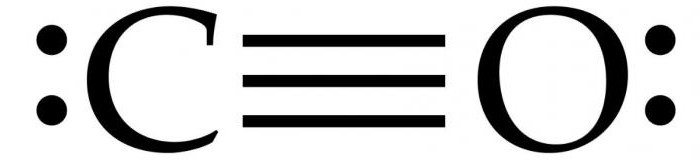
Anglies monoksido oksidacija
Anglies monoksidas susidaro iš dalies oksiduojant anglies turinčius junginius. CO susidaro, kai deguonies nepakanka, kad susidarytų anglies dioksidas (CO2), pavyzdžiui, kai veikia krosnis arba variklisVidaus degimo uždaroje erdvėje. Jei deguonies yra, taip pat kai kurių kitų atmosferos anglies monoksido koncentracija nudegimų, spinduliavimo, mėlyna šviesa, formavimo anglies dioksido, žinomas kaip anglies dioksido.
Anglies dujos, plačiai naudojamos iki 1960-ųjųPraėjusį šimtmetį vidaus apšvietimui, maistui gaminti ir šildymui sudėtis buvo CO kaip naudingas degalų komponentas. Kai kurie šiuolaikinės technologijos procesai, pvz., Lydymas geležies, vis dar gamina anglies monoksidą kaip šalutinį produktą. Labai CO junginys oksiduojamas CO2 kambario temperatūroje.

Ar yra gamtoje CO?
Ar yra gamtoje anglies monoksido? Vienas iš natūraliai atsirandančių šaltinių yra fotocheminės reakcijos, vykstančios troposferoje. Manoma, kad šie procesai sudarys apie 5 × 1012 kg medžiagos e; Kaip jau minėta, kiti šaltiniai yra ugnikalniai, miškų gaisrai ir kiti deginimo būdai.
Molekulinės savybės
Anglies monoksido molinė masė yra 28,0, kuridaro jį šiek tiek mažiau tankus nei oras. Ryšio tarp dviejų atomų ilgis yra 112,8 mikrometrai. Tai pakankamai arti, kad ji suteikia vieną iš galingiausių cheminių jungčių. Abu CO elemento elementai kartu turi apie 10 elektronų viename valentiniame apvalkale.
Paprastai organiniuose karboniluosejunginiai yra dviguba jungtis. Būdingas CO molekulės bruožas yra tas, kad tarp atomų yra stiprus trigubas ryšys su 6 bendrais elektronais 3 susietose molekulinėse orbitose. Kadangi 4 iš bendrųjų elektronų kilę iš deguonies atomo ir tik 2 iš anglies, viena sujungta orbitale užima du elektronai iš O2, formuojantis dative arba dipolinį ryšį. Tai sukelia molekulės poliarizaciją C ← O su nedideliu "-" anglies užpildu ir nedideliu deguonies "+" uždegimu.
Likusieji du susiję orbitalai užima vienąužpildyta dalelė iš anglies ir viena iš deguonies. Molekulė yra asimetriška: deguonis turi didesnį elektronų tankį nei anglies, taip pat šiek tiek teigiamai įkrautas, lyginant su neigiamu anglies kiekiu.

Priėmimas
Pramonėje anglies monoksido CO gamyba gaunama šildant be anglies dioksido arba vandens garų patekimo į anglį:
CO2 + C = 2CO;
H2O + C = CO + H2.
Paskutinį gautą mišinį taip pat vadina vandeniuarba sintezės dujos. Laboratorinėse sąlygose anglies monoksidas II, veikiant organinėmis rūgštimis koncentruotą sieros rūgštį, veikiančią kaip dehidratuojantis agentas:
HCOOH = CO + H2Apie;
H2C2Apie4 = CO2 + H2O.
Pagrindiniai simptomai ir pagalba dėl CO apsinuodijimo
Ar yra apsinuodijimas anglies monoksidu? Taip, ir labai stiprus. Apsinuodijimas anglies monoksidu yra dažniausiai pasitaikantis reiškinys visame pasaulyje. Dažniausiai pasitaikantys simptomai yra:
- silpnumo jausmas;
- pykinimas;
- galvos svaigimas;
- nuovargis;
- dirglumas;
- prastas apetitas;
- galvos skausmas;
- dezorientacija;
- regos sutrikimas;
- vėmimas;
- alpimas;
- traukuliai.
Tokių toksinių dujų poveikis gali sukeltididelę žalą, kuri dažnai gali sukelti ilgalaikes lėtines patologines sąlygas. Anglies monoksidas gali rimtai pakenkti nėščios motinos vaisiui. Aukos, pavyzdžiui, po gaisro, turėtų būti nedelsiant suteiktos. skubiai reikia paskambinti greitosios pagalbos automobiliu, suteikti prieigą prie gryno oro, pašalinti kvėpavimo aprangos apranga, ramus ir šiltas. Sunkus apsinuodijimas, kaip taisyklė, gydomas tik gydytojų priežiūroje ligoninėje.
Paraiška
Kaip jau minėta, anglies monoksidas yra toksiškas irTai pavojinga, tačiau tai yra vienas iš pagrindinių junginių, kurie šiuolaikinėje pramonėje naudojami organinei sintezei. CO naudojamas gaminti grynus metalus, karbonilus, fosgeną, anglies sulfoksidą, metilo alkoholį, formamidą, aromatinius aldehidus, skruzdžių rūgštį. Ši medžiaga taip pat naudojama kaip kuras. Nepaisant tolesnio toksiškumo ir toksiškumo, jis dažnai naudojamas kaip žaliava cheminėms medžiagoms gaminti.
Anglies monoksidas ir anglies dioksidas: koks skirtumas?
Monoksidas ir anglies dioksidas (CO ir CO2) dažnai yra klaidingi vieni kitiems. Abi dujos yra bekvapės ir bespalvės, ir abu turi neigiamos įtakos širdies ir kraujagyslių sistemai. Abi dujos gali patekti į organizmą per įkvėpus, odą ir akis. Šie junginiai, veikiami gyvu organizmu, turi keletą bendrų simptomų - galvos skausmas, galvos svaigimas, traukuliai ir haliucinacijos. Daugumai žmonių sunku nustatyti skirtumą ir nesupranta, kad automobilio išmetimai išskiria CO ir CO2 . Vidutiniškai šių dujų koncentracijos padidėjimas gali būti pavojingas žmogaus, su kuriuo jie susiduria, sveikatai ir saugumui. Koks skirtumas?
Esant didelėms koncentracijoms, abu gali būti mirtini. Skirtumas yra tas, kad CO2 yra bendros gamtinės dujos, reikalingosvisas augalų ir gyvulių gyvenimas. CO nėra įprastas įvykis. Tai yra anoksinio kuro deginimo šalutinis produktas. Svarbiausias cheminis skirtumas yra tas, kad CO2 yra vienas anglies atomas ir du deguonies atomai, o CO yra tik vienas iš jų. Anglies dioksidas yra nedegus, o monoksidas turi didelę degimo tikimybę.
Anglies dioksidas, žinoma, įvykstaatmosfera: žmonės ir gyvūnai įkvepia deguonį ir išmeta anglies dvideginį, tai yra, gyvosios būtybės sugeba atsikurti mažame kiekyje. Šios dujos taip pat reikalingos augalams atlikti fotosintezę. Tačiau anglies monoksidas natūraliai nesukelia atmosferoje ir gali sukelti sveikatos problemų net mažose koncentracijose. Abiejų dujų tankis taip pat skiriasi. Anglies dioksidas yra sunkesnis ir tankesnis nei oras, o anglies monoksidas yra šiek tiek lengvesnis. Į šią funkciją reikėtų atsižvelgti diegiant tinkamus jutiklius namuose.